Anvisa aprova remédio de R$ 17 milhões para tratar doença rara
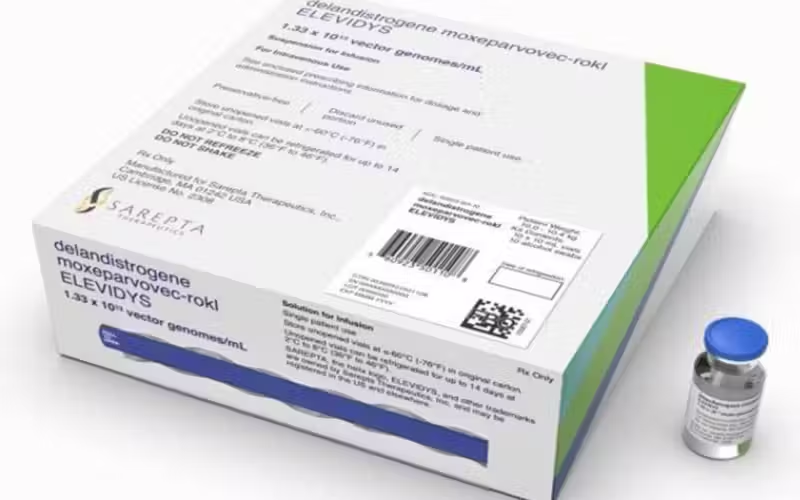
O remédio Elevidys, da farmacêutica Roche, foi aprovado pela Anvisa e está entre os mais caros do mundo: custa quase R$ 17 milhões. A medicação teve o registro aprovado para crianças de 4 a 7 anos com distrofia muscular de Duchenne.
A liberação é em caráter excepcional por causa da gravidade da doença e da falta de outros tratamentos para a condição.
É a primeira terapia gênica aprovada para as crianças que têm o diagnóstico da doença genética, que afeta a locomoção e causa problemas cardíacos e respiratórios.
Doença rara e progressiva
A distrofia muscular de Duchenne é uma condição genética rara e grave que se agrava com o tempo, levando ao enfraquecimento e à deterioração dos músculos do corpo do paciente.
É uma doença que ocorre devido a um gene defeituoso que resulta na ausência da distrofina, uma proteína que ajuda a manter as células musculares do corpo intactas.
Os sintomas de fraqueza muscular associados à DMD geralmente começam na infância, frequentemente entre 3 e 6 anos de idade. Entretanto, após o pico de aproximadamente 6 anos de idade.
Leia mais notícia boa
- Anvisa aprova remédio para câncer de pulmão; reduz morte em 76%
- Animais poderão ser tratados com Cannabis; autorização da Anvisa
- Anvisa autoriza registro de vacina contra bronquiolite em bebês; gestantes vão tomar
A nova medicação
O Elevidys® é um medicamento de terapia avançada, classificado como terapia gênica. Ele funciona utilizando um vetor viral para transportar um gene humano que codifica a microdistrofina, com o objetivo de substituir a proteína distrofina disfuncional ou ausente no organismo do paciente.
A expectativa é que o medicamento restaure, de forma parcial, a função muscular em pacientes pediátricos.
É administrado em uma única dose intravenosa, com a quantidade ajustada de acordo com o peso da criança, de acordo com informações da Anvisa.
Caráter experimental
A Anvisa (Agência Nacional de Vigilância Sanitária), concedeu o registro em caráter excepcional.
Para a concessão, foram considerados a gravidade e a raridade da doença, além da ausência de alternativas terapêuticas para os pacientes. A maioria das abordagens terapêuticas atuais trata os sintomas da doença.
Os tratamentos incluem medicamentos corticosteroides para retardar a progressão da fraqueza muscular, programas de alongamento e exercícios físicos e o uso de equipamentos, como órteses ou cadeira de rodas, à medida que caminhar se torna mais difícil.
Benefícios e riscos
Os benefícios do tratamento de pacientes, de 4 a 7 anos de idade, demonstram uma melhora significativa em funções essenciais, como a capacidade de ficar em pé, caminhar e subir escadas.
Esses benefícios superam os riscos associados ao tratamento. A relação entre benefícios e riscos é considerada favorável, mesmo diante de incertezas, como a duração da resposta terapêutica
Para pacientes acima de 7 anos e que perderam a capacidade de locomoção funcional, os dados disponíveis são limitados e ainda não são suficientes para verificar o benefício do uso do remédio.

 Anvisa autoriza 1ª vacina brasileira contra Chikungunya, do Butantan; maiores de 18 anos
Anvisa autoriza 1ª vacina brasileira contra Chikungunya, do Butantan; maiores de 18 anos Idosa de 74 comemora: vai se formar no EJA e quer fazer faculdade na UnB; vídeo
Idosa de 74 comemora: vai se formar no EJA e quer fazer faculdade na UnB; vídeo Pai tem reação linda ao saber que a filha comprou um apartamento; vídeo
Pai tem reação linda ao saber que a filha comprou um apartamento; vídeo Pai faz apelo emocionante para consertar Chevette 74 que usa para levar filha ao médico; doe na vaquinha
Pai faz apelo emocionante para consertar Chevette 74 que usa para levar filha ao médico; doe na vaquinha Caramelo abandonado é adotado em posto, leva vida de rei e hoje salva vidas; ‘Frentiscão’
Caramelo abandonado é adotado em posto, leva vida de rei e hoje salva vidas; ‘Frentiscão’ Páscoa: Fusca coelho surge nas ruas e faz maior sucesso, nas redes inclusive vídeo
Páscoa: Fusca coelho surge nas ruas e faz maior sucesso, nas redes inclusive vídeo Novo estudo mostra 4 alimentos que ajudam a viver até os 100 anos
Novo estudo mostra 4 alimentos que ajudam a viver até os 100 anos Repórter fofa chinesa explica porque Brasil ganha e Trump perde na briga com a China; vídeo
Repórter fofa chinesa explica porque Brasil ganha e Trump perde na briga com a China; vídeo Jogador famoso empurra carro quebrado de desconhecido na rua e gentileza viraliza
Jogador famoso empurra carro quebrado de desconhecido na rua e gentileza viraliza Cientistas britânicos fazem dentes crescerem em laboratório; novo estudo
Cientistas britânicos fazem dentes crescerem em laboratório; novo estudo