Anvisa autoriza uso emergencial de vacina contra Covid no Brasil
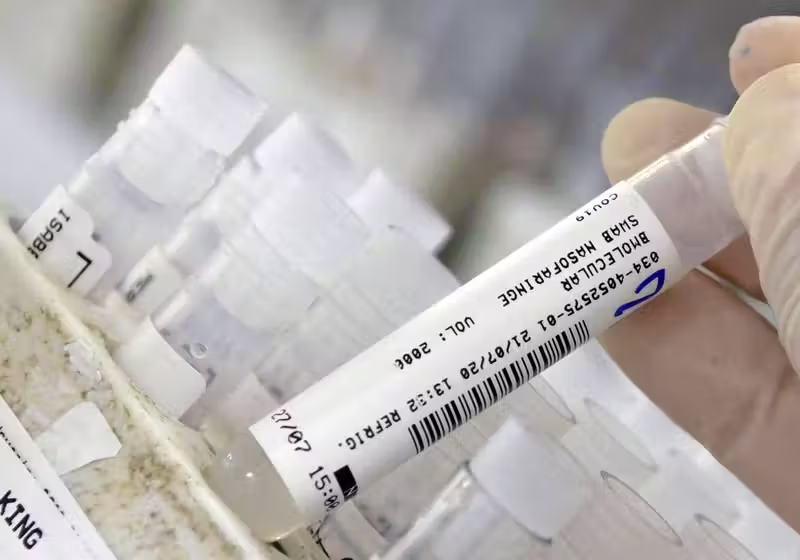
A Anvisa, Agência Nacional de Vigilância Sanitária, aprovou uma resolução que “abre possibilidade aos laboratórios de solicitarem autorização para uso emergencial, em caráter experimental, de vacinas contra covid 19”.
Na prática, a medida abre caminho para que empresas possam fazer esse pedido de emergência.
A decisão, saiu nesta quinta, 10 após a reunião da Diretoria Colegiada, que oficializou o pedido de uso emergencial de vacina anunciado no dia 2 de dezembro pela própria Anvisa.
“Qualquer autorização concedida pela Anvisa, qualquer anuência, só será feita diante de um pleito. A vacina só terá autorização de uso emergencial e experimental se houver o pleito realizado por alguma empresa”, disse Alessandra Bastos Soares, diretora da Anvisa.
Mas, segundo a agência, nenhum laboratório solicitou ainda o uso emergencial, mesmo após a Anvisa ter publicado um guia com os requisitos para esse pedido.
Como
Em nota, a Anvisa explicou como será o processo:
“Serão considerados dados de estudos não clínicos e clínicos, de qualidade, boas práticas de fabricação, estratégias de monitoramento e controle e resultados provisórios de ensaios clínicos, entre outras evidências científicas. Além disso, a empresa deve apresentar informações que comprovem que a fabricação e a estabilidade são adequadas para garantir a qualidade da vacina”.
Não substitui registro
A agência esclareceu que a autorização de uso emergencial e temporária é restrita a um “público previamente definido”, não substituindo o registro sanitário.
“A modalidade de uso emergencial e temporário está prevista em regulamento e pode trazer benefícios a determinados e controlados grupos, como medida adicional para o enfrentamento da pandemia. O pedido de uso emergencial e temporário deve ser submetido pela empresa desenvolvedora da vacina contra covid-19”, concluiu a Anvisa.
Com informações da Agência Brasil

 Angelina Jolie se reúne com cacique Raoni e visita terra de indígenas no Mato Grosso
Angelina Jolie se reúne com cacique Raoni e visita terra de indígenas no Mato Grosso Governo vai enviar mensagem via WhatsApp para quem usar celular roubado e alertar sobre devolução
Governo vai enviar mensagem via WhatsApp para quem usar celular roubado e alertar sobre devolução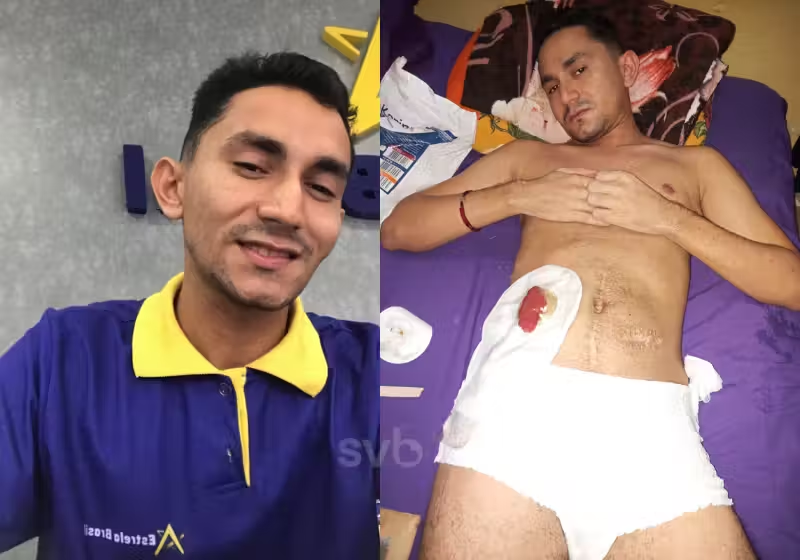 Jovem com câncer no reto tem INSS negado; mesmo debilitado, perícia diz que ele pode trabalhar. Ajude na vaquinha!
Jovem com câncer no reto tem INSS negado; mesmo debilitado, perícia diz que ele pode trabalhar. Ajude na vaquinha! Família faz caravana e aluga ônibus para visitar o tio desaparecido há 42 anos; vídeo
Família faz caravana e aluga ônibus para visitar o tio desaparecido há 42 anos; vídeo Escola instala elevador para tornar ambiente mais acessível aos alunos com deficiência
Escola instala elevador para tornar ambiente mais acessível aos alunos com deficiência Fisioterapeuta leva sanfona para paciente internado e ele tem a melhor reação; ‘música é vida’
Fisioterapeuta leva sanfona para paciente internado e ele tem a melhor reação; ‘música é vida’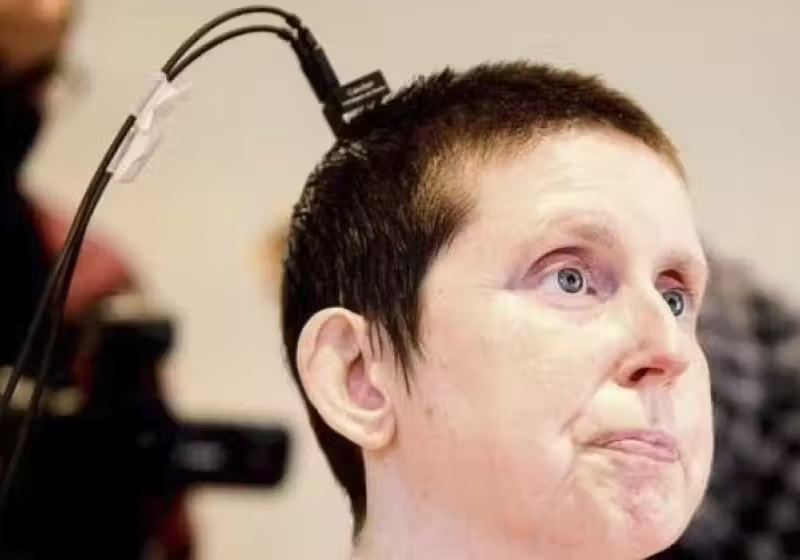 Após 18 anos, mulher volta a falar por causa de neuroprótese; inovador!
Após 18 anos, mulher volta a falar por causa de neuroprótese; inovador!